
合作文章丨Small:南京医科大学发现基于耗竭血清的蛋白冠化材料修饰新策略
发布时间:
2023-07-28 15:33:01
南京医科大学药学院霍达教授课题组于2022年7月1日以全文形式在Wiley旗下材料科学杂志 Small (IF:15)上在线发表论文,提出了基于耗竭血清的蛋白冠材料修饰的新策略。唯誉智合科技(Verygenome Technology)为本研究提供了Labelfree蛋白质组学相关技术支持。
蛋白冠效应一直以来就被认为是限制纳米药物传递功效的最本源的问题。纳米材料的蛋白冠效应指的是当纳米材料进入体内,暴露在血液之后,通过补体激活系统,或者由于疏水,电荷吸引等方式,在材料表面被动的覆盖一层血清蛋白,这层蛋白与帽子类似,因此被称为蛋白冠。蛋白冠的存在会改变材料表面原本修饰的配体与既定靶向群体的膜受体之间的作用模式,并且蛋白冠上面的蛋白可以分为两类,一类是会缩短纳米材料在体内半衰期的蛋白,称为调理素(opsonin),与之对应的,另一类是可以增长纳米材料在体内半衰期的蛋白,称为逆调理素(dysopsonin),因此纳米药物的研发就需要尽可能的去除调理素,最大程度的保留逆调理素,从而提高纳米药物的递送效率,降低其细胞毒性。
南京医科大学药学院霍达教授课题组于2022年7月1日以全文形式在Wiley旗下材料科学杂志 Small (IF:15)上在线发表论文,提出了基于耗竭血清的蛋白冠材料修饰的新策略。
引入耗尽的血清以产生携带不同功能的蛋白冠的纳米材料,称为PCylated纳米材料。研究证明利用耗尽的血清对纳米材料进行钝化可以有效的降低毒性和促炎反应,除此之外,可以利用相同的方法来增强纳米材料进行内吞的能力以及他们作为NF-κB通路激活剂的潜力,而NF-κB的不正确调节与癌症相关。文章首先合成了五种不同的纳米金材料,为了进行PCylation,首先对相同的血清进行重复消耗,在此期间收集沉淀物并标记,最终创建一个包含50个PCylated纳米材料的库(图1a)。接下来,文章通过透射电子显微镜研究表面功能化带来的潜在变化,发现所有类型的功能化对纳米晶体的形状和分散性的影响都可以忽略不计(图1b)。动态光散射分析结果表明,5种纳米材料的平均流体动力学直径分别增加到82.53±3.19、67.99±0.99、71.65±4.02、44.16±1.00和106.33±2.24nm(图1c)。为了量化配体密度,文章使用DTNB(5,5'-二硫代双-(2-硝基苯甲酸))来可视化PEG的硫醇基团,由于DTNB裂解为NTB,硫醇上的PEG与DTNB的加合物会产生光吸附,通过在与纳米球孵育之前和之后测量PEG的硫醇浓度,可以量化纳米材料消耗的PEG百分比,结合相应的纳米球浓度(通过电感耦合等离子质谱(ICP-MS)分析的金含量计算得到),计算得出每个球体有364、283、291、642、173个配体。接下来测量了五种纳米材料的Zeta电位值(图1d),这与之前的报告一致,证实了通过使用特定的大分子进行表面功能化的这一步骤的成功。
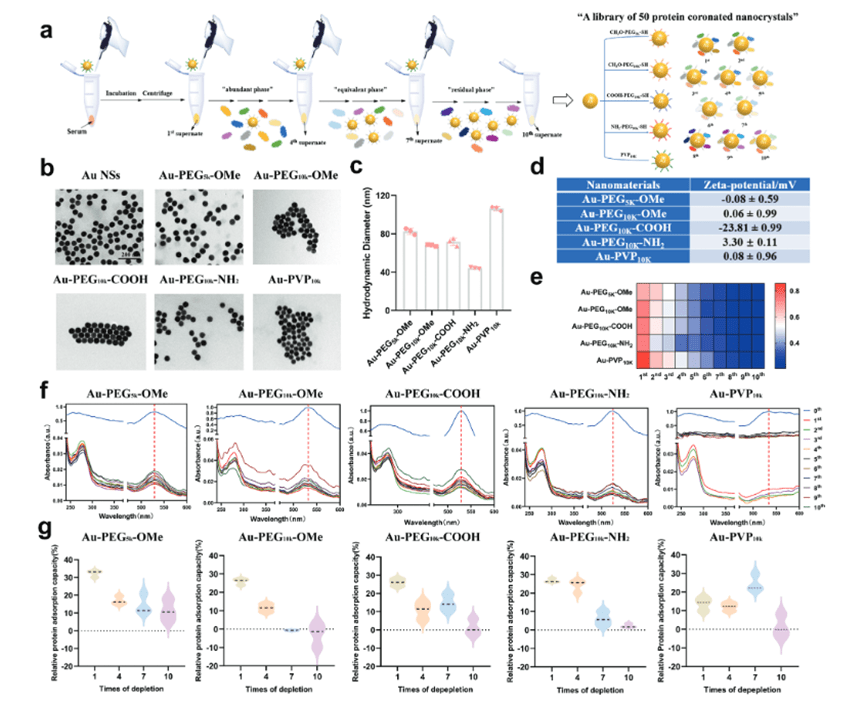
文章接下来通过使用BCA测定法分析通过重复纳米材料暴露的血清消耗效应,分析了纳米材料的浓度如何影响它们的蛋白质消耗能力。发现纳米材料越大,消耗效率越高(对于最高浓度情况下,一次性孵育可能消耗超过20%的蛋白质)。为了避免一次性孵育过程中吸附过度或不充分,文章在接下来采用优化浓度为61.32μg·mL-1(约10%的血清蛋白消耗)的纳米金材料,图1e显示了可视化的浓度热图。反复暴露于包裹有NH2的纳米材料会导致最快的消耗(在2次孵育内减少47.95%),而对于带负电荷或接近中性电荷的对应物,尽管在前4次中消耗了更多的蛋白质,但此后的蛋白质的吸附变得缓慢。根据前人的研究,正电荷有利于吸附白蛋白和可能的其他型的血清丰富蛋白质。通过记录纳米材料库中每个组分的紫外光谱(图1f),研究每一步的消耗变化。发现在所有组中,剩余蛋白质对纳米材料的吸引力与消耗时间呈负相关,此外,加帽分子的长度也会影响蛋白质吸附曲线,相对于较短的对应物,链长较长的PEG可以更有效地保护纳米材料不形成蛋白质冠。
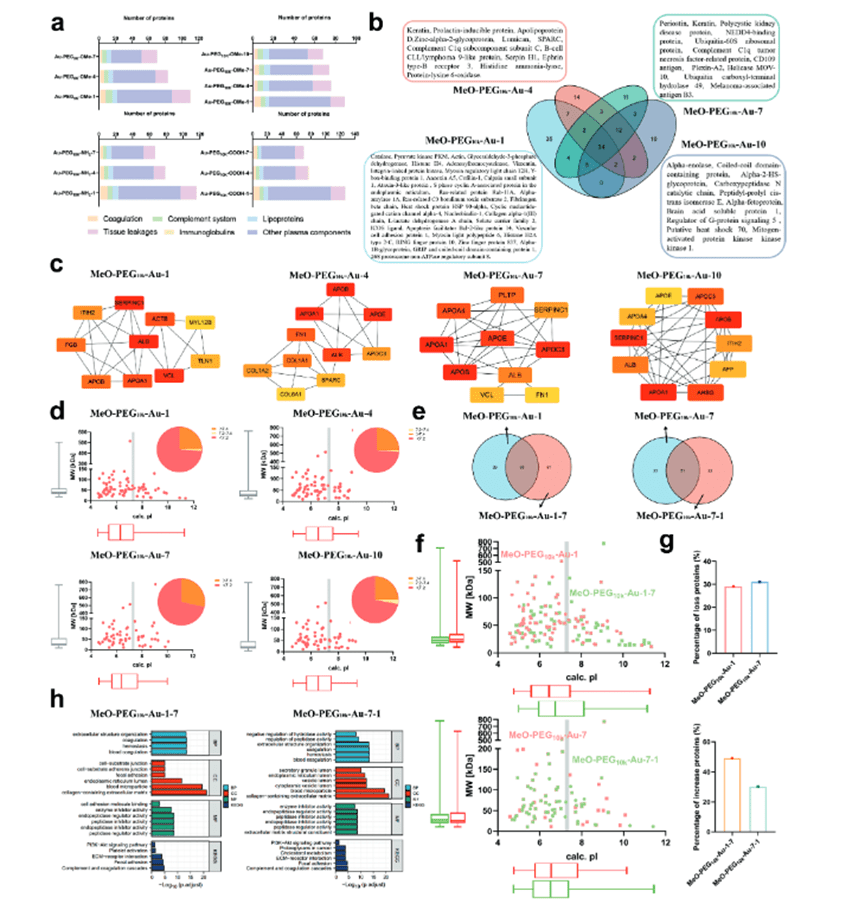
为了更好地了解所获得的PCylated纳米材料的特性,文章采用了Labelfree蛋白质组学研究了10个代表性样品的蛋白构成。发现纳米材料上的蛋白质类型随着消耗时间的变化而持续下降(图2a),这与蛋白质数量方面的耗尽曲线一致。通过维恩图分析(图2b),发现Au-PEG10k-OMe亚组的第4和第7个样品不仅具有相似类型的蛋白质,并且共有51类蛋白质。对于中性纳米材料,它们暴露于原始血清会导致形成以血清中大量蛋白为主的PCylated纳米材料。对于这样的蛋白质,它们中的一部分可能会被大量消耗,导致它们在后期被淘汰。鉴于纳米材料中血清蛋白:纳米材料的比例非常高,这个阶段被称为“丰富阶段”。前期这些蛋白质的减少使得那些不太丰富的蛋白与纳米材吸附成为可能。接下来就会进入“等效阶段”,这一阶段的蛋白质种类只有微小变化。最后,在前两个阶段没有被耗尽的蛋白,它们开始接触到纳米晶体,从而形成吸附的后期阶段,称为“耗尽阶段”。对于在这个阶段出现的成分,它们数量较少或表现出与纳米晶体的不利结合(图2c)。进一步评估吸附蛋白的等电点(PI)和分子量(图2d),观察到大多数耗尽的蛋白质都带有负电荷,与作为底物的纳米晶体无关。文章将分子量(Mw)高于100kDa的蛋白质归类为大蛋白质,而Mw小于15kDa的对应物被视为小蛋白质,研究发现,几乎20-30%的蛋白冠由大蛋白组成,对小蛋白只有一小部分吸引力(<5%)(图2a)。维恩图(图2e)表明,Au-PEG-OMe-7表现出对蛋白质交换的异常稳定性(图2f,2g),进一步进行了GO分析(图2h),结果证明某些类型的蛋白质未能吸附到纳米晶体上既不是防污效果也不是由于与纳米表面的结合强度不足,而是更可能是由于对纳米晶体的可及性差的结果。唯誉智合科技(Verygenome Technology)为本研究提供了Labelfree蛋白质组学相关技术支持。
文章通过合成PCylated纳米材料库,全面研究了PCylation策略如何从多个方面影响纳米材料,进行了大量的实验,以验证PCylation用于精密纳米疗法的潜力,发现当血清被纳米材料预吸附数次之后,再利用它所形成的的蛋白冠,可以削弱原本对细胞毒性较大的正电性材料造成的损伤,同时可以增强内吞作用,甚至可以帮助其提升对于内皮或巨噬细胞的选择性,采用经过预吸附的晚期胃癌患者来源血清对纳米材料进行蛋白冠化修饰,可以提高纳米药物的摄取效率,延缓癌细胞的转移,同时对正常内皮细胞的影响可以忽略不计。

文章提出了可以使用源自患者的血清作为一种优质的生物流体来优化纳米药物,对于某些疾病,PCylated纳米材料也可能具有无创诊断价值,文章报道的方法有助于提高纳米药物的相容性和递送效率,从而为精准纳米治疗服务。
该研究由南京医科大学药学院2020级博士生王婵完成并以唯一第一作者身份撰文发表,南京医科大学药学院霍达教授、南京大学医学院附属鼓楼医院刘芹教授、江苏省人民医院肿瘤科张皓医生为本文的共同通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202202002
相关新闻









